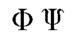単発質問トピックを立てないで,できるだけこちらで.
【注意】
まずは教科書やぐーぐる先生に相談すること.
宿題丸投げやレポート代行依頼みたいなのは,基本,through で.
参考.
教えてくん養成マニュアル : http://
学生さんへ:
卒業研究等に関するもので,とくに論文や学会に未発表の内容に関する質問は,
秘密保持等の問題があるので,指導教員の許可なく質問してはいけません.
違法行為や公序良俗を害する行為につながる書き込みも through で.
爆弾,毒薬等の作り方,処分法等々が思いつきますが,皆さんの
良識で判断してください.
前スレ
【総合質問スレッド 3】
http://
【総合質問スレッド 2】
http://
【総合質問スレッド】
http://
【注意】
まずは教科書やぐーぐる先生に相談すること.
宿題丸投げやレポート代行依頼みたいなのは,基本,through で.
参考.
教えてくん養成マニュアル : http://
学生さんへ:
卒業研究等に関するもので,とくに論文や学会に未発表の内容に関する質問は,
秘密保持等の問題があるので,指導教員の許可なく質問してはいけません.
違法行為や公序良俗を害する行為につながる書き込みも through で.
爆弾,毒薬等の作り方,処分法等々が思いつきますが,皆さんの
良識で判断してください.
前スレ
【総合質問スレッド 3】
http://
【総合質問スレッド 2】
http://
【総合質問スレッド】
http://
|
|
|
|
コメント(1000)
質問です。とても小さな疑問なのですが、、、
中2で『質量保存の法則』を習う時に、
NaHCO3 + HCl ⇒ NaCl + CO2↑ + H20
の実験には、密閉容器をつかい、
NaOH + NH4Cl ⇒ NH3↑ + NaCl + H2O
の実験には二股試験管を使っています。
【質問?】
両実験とも『個体』と『液体』を混ぜて使っているので、
密閉容器でも、二股試験管でも良いような気がしますが、
何か、理由はあるのでしょうか??
【質問?】
ゴム風船以外で蓋をとめると何か不都合が生じるのでしょうか??
自分なりの見解では、
【見解?】
二股試験管は、『少量の気体を発生させる時に使い』
『多量の気体を発生させる時は密閉容器を使う』
【見解?】
試験管の口をふさぐのに適した道具はゴムしかないから??
あまり、実験の本質とは関係ない疑問ですが、適した器具の
使い方があるのかな、と重い質問させてもらいました。
よろしければ、ご回答お願いいたします。
(小さな疑問すぎるのか、調べても答えは分かりませんでした、、、)
中2で『質量保存の法則』を習う時に、
NaHCO3 + HCl ⇒ NaCl + CO2↑ + H20
の実験には、密閉容器をつかい、
NaOH + NH4Cl ⇒ NH3↑ + NaCl + H2O
の実験には二股試験管を使っています。
【質問?】
両実験とも『個体』と『液体』を混ぜて使っているので、
密閉容器でも、二股試験管でも良いような気がしますが、
何か、理由はあるのでしょうか??
【質問?】
ゴム風船以外で蓋をとめると何か不都合が生じるのでしょうか??
自分なりの見解では、
【見解?】
二股試験管は、『少量の気体を発生させる時に使い』
『多量の気体を発生させる時は密閉容器を使う』
【見解?】
試験管の口をふさぐのに適した道具はゴムしかないから??
あまり、実験の本質とは関係ない疑問ですが、適した器具の
使い方があるのかな、と重い質問させてもらいました。
よろしければ、ご回答お願いいたします。
(小さな疑問すぎるのか、調べても答えは分かりませんでした、、、)
>>[979]
イマイチ状況がわからないので、あくまでも予想です。間違ってるかもしれないので、参考程度にしてください。
まず蓋に風船を使う理由です。これは他のもの、例えばコルク栓のようなものを使った場合を考えてください。
完全に試験管内が密閉された状態で、中和反応が起き、内部の気体が増えていきますよね?その場合自分自信が膨らむ風船ではなくコルク栓だと、おそらく栓はぶっ飛びます。危ないです。最悪ガラスが割れます。
さて、もうひとつの方ですが、まず見解の方から
気体の出る量が違うと書いていますがなぜそう思ったのでしょうか?
反応式だとどちらも同じ量出ていますよね?
正直なぜ容器を代えているのかは、よくわかりません。
ただもしかしたら出てくる気体の性質の違いによるのかもしれませんね。
というわけで、出てくる気体について調べてみたらどうでしょうか?特に水にとけるかどうかなどを調べるといいかも……。
イマイチ状況がわからないので、あくまでも予想です。間違ってるかもしれないので、参考程度にしてください。
まず蓋に風船を使う理由です。これは他のもの、例えばコルク栓のようなものを使った場合を考えてください。
完全に試験管内が密閉された状態で、中和反応が起き、内部の気体が増えていきますよね?その場合自分自信が膨らむ風船ではなくコルク栓だと、おそらく栓はぶっ飛びます。危ないです。最悪ガラスが割れます。
さて、もうひとつの方ですが、まず見解の方から
気体の出る量が違うと書いていますがなぜそう思ったのでしょうか?
反応式だとどちらも同じ量出ていますよね?
正直なぜ容器を代えているのかは、よくわかりません。
ただもしかしたら出てくる気体の性質の違いによるのかもしれませんね。
というわけで、出てくる気体について調べてみたらどうでしょうか?特に水にとけるかどうかなどを調べるといいかも……。
>>[980]
秋さん、返信有難うございます。
>イマイチ状況がわからないので、あくまでも予想です。
不手際でした。大変申し訳ありません。参考のURLを載せておきます。
【NaHCO3 + HCl ⇒ NaCl + CO2↑ + H20】 の実験図
http://www.art-kobo.co.jp/web_zuhan_kobo/html/products/detail.php?product_id=5468
【NaOH + NH4Cl ⇒ NH3↑ + NaCl + H2O】 の実験
http://www.ons.ne.jp/~taka1997/education/2003/chemistry/09/index.html
>気体の出る量が違うと書いていますがなぜそう思ったのでしょうか?
>反応式だとどちらも同じ量出ていますよね?
これは、【二股試験管】で検索していたら、【二股試験管は
少量の気体を発生するのに用いる】というような記述を見かけた
からです。
ただ、気体は体積が膨大なので、超大型の密閉容器を使わない限り
密閉容器だろうが、二股試験だろうがあまり変わらないのでは、
という疑問もありますが、、、。
>特に水にとけるかどうかなどを調べるといいかも……。
CO2とNH3は水にとけるはずですので、性質上はそこまで変わらないと
思いまして、、、
秋さん、返信有難うございます。
>イマイチ状況がわからないので、あくまでも予想です。
不手際でした。大変申し訳ありません。参考のURLを載せておきます。
【NaHCO3 + HCl ⇒ NaCl + CO2↑ + H20】 の実験図
http://www.art-kobo.co.jp/web_zuhan_kobo/html/products/detail.php?product_id=5468
【NaOH + NH4Cl ⇒ NH3↑ + NaCl + H2O】 の実験
http://www.ons.ne.jp/~taka1997/education/2003/chemistry/09/index.html
>気体の出る量が違うと書いていますがなぜそう思ったのでしょうか?
>反応式だとどちらも同じ量出ていますよね?
これは、【二股試験管】で検索していたら、【二股試験管は
少量の気体を発生するのに用いる】というような記述を見かけた
からです。
ただ、気体は体積が膨大なので、超大型の密閉容器を使わない限り
密閉容器だろうが、二股試験だろうがあまり変わらないのでは、
という疑問もありますが、、、。
>特に水にとけるかどうかなどを調べるといいかも……。
CO2とNH3は水にとけるはずですので、性質上はそこまで変わらないと
思いまして、、、
[高校化学です]
答えがなく、解答が合ってるか不安ですので、
もし、考え方等が間違っていたら教えて下さい。
『問題』
質量パーセント濃度が94%の濃硫酸がある。この濃硫酸の密度は
1.8g/cm3 であるとする。
この濃硫酸を水で希釈してpHが正確に1である希硫酸を1.0L作る際に
必要な濃硫酸の体積をml単位で求めよ。
硫酸の分子量は98、電離度は1とする。
必要な濃硫酸の体積を『Y』とおくと、
pHが1の時の濃硫酸のモル数は
1.8*Y/98 [mol] ------?
pHが1の時の希硫酸のモル濃度を『Z』とおくと価数は2、
電離度は1より、
[H+] = 1*10^-1 = 2*Z*1
Z=0.5*10^-1 [mol/L]-------?
----ここからが自信がないのですが、-----
問題は1.0Lの希硫酸を作ることを前提にしてあるので、
?は1.0L中に 0.5*10^-1 [mol]存在している。
また?に水を加えて1Lにするので、mol数は
? = ?となる
Y=2.72(四捨五入しました)
よって答え 2.72[ml]
考え方や間違えがある場合はご指摘いただければ幸いです。
よろしくお願い致します。
答えがなく、解答が合ってるか不安ですので、
もし、考え方等が間違っていたら教えて下さい。
『問題』
質量パーセント濃度が94%の濃硫酸がある。この濃硫酸の密度は
1.8g/cm3 であるとする。
この濃硫酸を水で希釈してpHが正確に1である希硫酸を1.0L作る際に
必要な濃硫酸の体積をml単位で求めよ。
硫酸の分子量は98、電離度は1とする。
必要な濃硫酸の体積を『Y』とおくと、
pHが1の時の濃硫酸のモル数は
1.8*Y/98 [mol] ------?
pHが1の時の希硫酸のモル濃度を『Z』とおくと価数は2、
電離度は1より、
[H+] = 1*10^-1 = 2*Z*1
Z=0.5*10^-1 [mol/L]-------?
----ここからが自信がないのですが、-----
問題は1.0Lの希硫酸を作ることを前提にしてあるので、
?は1.0L中に 0.5*10^-1 [mol]存在している。
また?に水を加えて1Lにするので、mol数は
? = ?となる
Y=2.72(四捨五入しました)
よって答え 2.72[ml]
考え方や間違えがある場合はご指摘いただければ幸いです。
よろしくお願い致します。
>>[992]
金属の錆びやすさはいくつかの要素があります。
?イオン化傾向
(大)卑金属⇔貴金属(小)
イオンになりやすい金属は錆びやすい。イオンになりにくい金属は錆びにくい。
?酸化皮膜
表面の金属原子が酸素と化合して酸化物を作ります。酸化皮膜となって表面を覆い、それ以上の酸素の侵入を阻止するため、外見上錆びないように見えます。
チタンやステンレスなどがこれに当たります。
鉄は錆びやすいが、ステンレスはクロムを含む緻密な酸化皮膜が形成されるため錆びにくい。→不動態皮膜という。
アルミニウムはイオン化傾向が大きいが、空気中で酸化皮膜が瞬時に形成されるため錆びにくい。
また形成される酸化物の量が重要です。量が適正でないと金属表面を隙間なく覆うことが出来ない。
少ないと、皮膜がひび割れ。
多いと皮膜が盛り上がってしまい不整になり、隙間が出来てしまう。
→金属が酸素と接触し錆びます。
?金属の純度
普通の鉄は錆びますが、極度に純度を上げると錆びにくくなります。外観は輝きを増し『銀』のようになります。
アルミニウムが錆びにくいのは先に書きましたが、それは純度が高い場合です。亜鉛も高純度なら酸に溶かされにくい。
何故か?不純物(異種金属など)が存在すると電池が形成されて、イオン化傾向の大きい方の金属が溶け出すためです。
不純物を含まない極めて均一な金属はイオン化傾向が大きくても錆びにくいと言えます。
?金属と腐食物質の相性
チタンは乾燥した塩素ガスとは激しく反応して発火する場合もあります。
銀は酸素に対しては徐々に酸化されるのみだが、硫黄には速やかに反応し黒い硫化銀を形成する。
など.. 人類が実用的な金属を利用するようになった歴史は、即ち錆(腐食)との戦いの歴史でもありました。金属と錆は大変奥深いものです。詳しくは本などで調べて下さい。
金属の錆びやすさはいくつかの要素があります。
?イオン化傾向
(大)卑金属⇔貴金属(小)
イオンになりやすい金属は錆びやすい。イオンになりにくい金属は錆びにくい。
?酸化皮膜
表面の金属原子が酸素と化合して酸化物を作ります。酸化皮膜となって表面を覆い、それ以上の酸素の侵入を阻止するため、外見上錆びないように見えます。
チタンやステンレスなどがこれに当たります。
鉄は錆びやすいが、ステンレスはクロムを含む緻密な酸化皮膜が形成されるため錆びにくい。→不動態皮膜という。
アルミニウムはイオン化傾向が大きいが、空気中で酸化皮膜が瞬時に形成されるため錆びにくい。
また形成される酸化物の量が重要です。量が適正でないと金属表面を隙間なく覆うことが出来ない。
少ないと、皮膜がひび割れ。
多いと皮膜が盛り上がってしまい不整になり、隙間が出来てしまう。
→金属が酸素と接触し錆びます。
?金属の純度
普通の鉄は錆びますが、極度に純度を上げると錆びにくくなります。外観は輝きを増し『銀』のようになります。
アルミニウムが錆びにくいのは先に書きましたが、それは純度が高い場合です。亜鉛も高純度なら酸に溶かされにくい。
何故か?不純物(異種金属など)が存在すると電池が形成されて、イオン化傾向の大きい方の金属が溶け出すためです。
不純物を含まない極めて均一な金属はイオン化傾向が大きくても錆びにくいと言えます。
?金属と腐食物質の相性
チタンは乾燥した塩素ガスとは激しく反応して発火する場合もあります。
銀は酸素に対しては徐々に酸化されるのみだが、硫黄には速やかに反応し黒い硫化銀を形成する。
など.. 人類が実用的な金属を利用するようになった歴史は、即ち錆(腐食)との戦いの歴史でもありました。金属と錆は大変奥深いものです。詳しくは本などで調べて下さい。
酸化数という概念が破綻する場合もあるし,かなり便法的なものでもあるので,997にあるように「絶対はない」ということは基本です.
「鉄則のルール」は,「元素単体は0とする」(厳密には微妙な場合もある),「中性化合物は全体で0」,「イオンは全体でその電荷数と一致」くらいでしょうね.
水素は +1 が多いとはいえ, -1 という水素化物という物質群もあります.酸素は -2 が多いけど,過酸化物では -1 になります.とか,まあ,結構例外のような状況はあると.
さて,996の場合だと,こんな風に.
KCl … アルカリ金属は,単体なら 0,化合物なら+1という原則を適用.この原則は,かなり厳密に当てはまります.なぜなら,電子構造的に最外殻にある1個だけのs電子は,核からも比較的遮蔽されており,しかもこれがなくなれば安定な閉殻構造を取れるため,何かおこるとしたらこれが取れるというのがまっさきに起こるべきこととなるからです.ここに,化合物全体では0という原則を当てはめると,Clは-1となります.そして,ハロゲンは-1という酸化数を取りやすいという事実と矛盾がないので,これで解決となるわけ.ハロゲンが-1を取りやすいというのも,電子構造から理解できます.実際,KCl を見ずに溶かすと K+ (イオンの酸化数の原則から +1) と Cl- (同じく -1) となることから,化合物としてのKClもこのような性質を強く持っていると考えることは自然でしょう.
FeS … まず,遷移元素は複数の酸化状態を比較的安定に取れるものが多いことを知る必要があります.Fe の場合は,通常は単体の 0 でなければ +2 か +3 です.+4 ということもあるのですが,高校段階ではお目にかからないでしょうね.一方,S は O の同族です.したがって基本的に -2 を取りやすい.
あとは,どういう元素 (族あるいは類でまとめて類似性を考える) がどういう酸化数を取りやすいか (大概は例外が見つかるので,あくまでも「取りやすい」) というのを整理して,さらに電子構造の観点から考えられるようになるとほぼ完璧です.
「鉄則のルール」は,「元素単体は0とする」(厳密には微妙な場合もある),「中性化合物は全体で0」,「イオンは全体でその電荷数と一致」くらいでしょうね.
水素は +1 が多いとはいえ, -1 という水素化物という物質群もあります.酸素は -2 が多いけど,過酸化物では -1 になります.とか,まあ,結構例外のような状況はあると.
さて,996の場合だと,こんな風に.
KCl … アルカリ金属は,単体なら 0,化合物なら+1という原則を適用.この原則は,かなり厳密に当てはまります.なぜなら,電子構造的に最外殻にある1個だけのs電子は,核からも比較的遮蔽されており,しかもこれがなくなれば安定な閉殻構造を取れるため,何かおこるとしたらこれが取れるというのがまっさきに起こるべきこととなるからです.ここに,化合物全体では0という原則を当てはめると,Clは-1となります.そして,ハロゲンは-1という酸化数を取りやすいという事実と矛盾がないので,これで解決となるわけ.ハロゲンが-1を取りやすいというのも,電子構造から理解できます.実際,KCl を見ずに溶かすと K+ (イオンの酸化数の原則から +1) と Cl- (同じく -1) となることから,化合物としてのKClもこのような性質を強く持っていると考えることは自然でしょう.
FeS … まず,遷移元素は複数の酸化状態を比較的安定に取れるものが多いことを知る必要があります.Fe の場合は,通常は単体の 0 でなければ +2 か +3 です.+4 ということもあるのですが,高校段階ではお目にかからないでしょうね.一方,S は O の同族です.したがって基本的に -2 を取りやすい.
あとは,どういう元素 (族あるいは類でまとめて類似性を考える) がどういう酸化数を取りやすいか (大概は例外が見つかるので,あくまでも「取りやすい」) というのを整理して,さらに電子構造の観点から考えられるようになるとほぼ完璧です.
- mixiユーザー
- ログインしてコメントしよう!
|
|
|
|
化学の道 更新情報
-
最新のアンケート
-
まだ何もありません
-
化学の道のメンバーはこんなコミュニティにも参加しています
人気コミュニティランキング
- 1位
- カラオケ「町田オフ」
- 981人
- 2位
- 暮らしを楽しむ
- 75438人
- 3位
- 酒好き
- 170636人