だいぶ間があいた上に、1ヶ月前の論文ですが。
側坐核(Nucleus Accumbens:NAc)や扁桃体外側基底核(Basolateral Amygdala:BLA)などの報酬・依存に関係しているとされている辺縁系の神経核は腹側被蓋野(Ventral Tegmental area:VTA)からドーパミン(Dopamine:DA)による投射を受けている。
VTAのドーパミン神経は薬物依存に強く関係しているとされ、また、NAcやBLAも報酬系においてVTAとは独立した役割を果たしている、とされている。
VTAの神経は一次(primary),二次(secondary),三次(tertiary)という3つのクラスに分けられている。primary neuronはチロシン水酸化酵素(Tyrosine hydroxylase:TH)ポジティブなドーパミン神経であり、secandary neuronはGABAergicである。
また、primaryとtertiaryの神経ではhyperpolarization-activated cation current (Ih)やpace maker firing, long-duration action potentials (APs)といった特徴がある。secondaryの神経はIhがなく、APsの幅も狭い。
オピオイドは鎮痛や鎮咳、下痢止めの薬の成分として用いられ、特にアヘンのケシから精製されるモルヒネ(morphine)は重要なオピエート鎮痛薬である。内在性のオピオイドをコードする遺伝子はβ-エンドルフィンの前駆体であるPOMC、Met-エンケファリンとLeu-エンケファリンの前駆体であるプロエンケファリン、ダイノルフィンの前駆体であるプロダイノルフィンの三種類が存在する。内在性オピオイドのN末端にはTry-Gly-Gly-Pheの共通配列があり、さらにMetかLeuがそれに続く。
オピオイドの受容体はG蛋白共役型受容体(GPCR)としてμ、κ、δの三種類が存在する。それぞれGi/oと共役しているため、
神経におけるリガンドの結合は抑制性に働く。モルヒネ様のオピオイド類やβ-エンドルフィンはμ受容体に優先的に結合する。それに対し、エンケファリンはδ受容体に優先的に結合し、ダイノルフィンはκ受容体に優先的に結合する。
VTAではμオピオイド受容体(μ-opioid receptor:MOR)とκオピオイド受容体(κ-opioid receptor:KOR)が発現している。KORのアゴニストはprimaryとtertiaryの神経を抑制し、MORのアゴニストはsecondaryとtertiaryの神経を抑制する。このsecondary neuronにおけるGABAの放出の抑制が、MORのアゴニストであるモルヒネなどによるドーパミン神経の活性化をもたらし、報酬性・依存性を引き起こす原因になっていると考えられる。
今回紹介する論文では、BLAもしくはNAcに逆行性のトレーサーを注入し、それぞれに投射しているVTAのドーパミン神経がオピオイドの感受性に対して違いを持っているか、ということを検証している。
Ford CP, Mark GP, Williams JT.
Properties and opioid inhibition of mesolimbic dopamine neurons vary according to target location.
J Neurosci. 2006 Mar 8;26(10):2788-97.
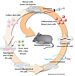
6〜8週齢のDBA/2Jマウスを麻酔し、fluorescent microspheres(invitrogen)をNAcもしくはBLAの両側に注入する。2〜5日でmicrosphereは逆行性に移行するため、電気生理学的解析に用いる。
解析したいのはprimaryなドーパミン神経であるため、アクションポテンシャルのスパイクの長さが1.2 msecのものを選択する。
まず、KORのアゴニストとMORのアゴニストについて作用を比較した。KORのアゴニストであるU69593はGIRKを活性化することでVTAのprimaryとtertiaryの神経を抑制することが報告されているが、この論文ではNAcに投射している神経はBLAに投射している神経と比較して非常に大きな外向き電流が流れた。
それに対しμとδのオピオイド受容体アゴニストであるメチオニンエンケファリン(ME)はNAcよりもBLAに投射している神経において大きな外向き電流を流した。
このように同じVTAのドーパミン神経であっても、オピオイドに対する感受性は異なる。特にμ受容体が側坐核(NAc)に投射している神経に少ない、という結果は、モルヒネ依存においてVTA-NAcという系の関与が低い、という事につながるかもしれない。
primaryなドーパミン神経はsecandaryであるGABA神経からの抑制を受けている。次に彼らはこのGABAergic neuronに対するpresynapticな作用を解析した。その結果、μ/δORのアゴニストであるMEはGABAA,GABABのIPSCを抑制した。それに対し、κORのアゴニストであるU69593はBLAに投射しているドーパミン神経のみでGABAA IPSCを抑制し、NAcに投射しているドーパミン神経ではこの抑制作用が見られなかった。逆に、GABAB IPSCはNAc投射神経のほうがBLA投射神経よりも有意に抑制された。
筆者らはここで、BLAに投射しているドーパミン神経ではGABAA受容体が多く発現し、NAcに投射しているドーパミン神経ではGABAB受容体が多く発現しているのかもしれない、と考察しているが、それならばMEなどの反応でも差が出るはずなのではなかろうか。むしろsecondary GABAergic neuronでもκオピオイド受容体の発現に差がある、と見るのが適当だと思うのだが、違うのだろうか?
最後に細胞体や樹状突起からretrogradeに放出されるドーパミンによるD2 IPSCの解析。5回連続で刺激をするとsomato-dendriticなドーパミン放出によるD2 IPSCが観察できるらしい。
その結果、μ/δORアゴニストのMEを作用させてもIPSCの抑制は起こらないが、κORのアゴニストを作用させるとIPSCは抑制されることが分かった。
MEがD2 IPSCにおいて全く作用を及ぼさなかった点について筆者らは、MEの量が足りなかったか、刺激によるDAの放出とμORによるDA IPSC抑制の効果が上手くカップルできなかったせいのどちらかではないか、と考察している。
今回の論文では、同じVTAのドーパミン神経でも投射先によってオピオイドの感受性が異なる、という結果を報告している。
このような投射先によるオピオイド受容体の発現パターンの違いは報酬・依存などにおいて何らかの生理的役割を果たしているのであろうが、BLAだと恐怖・不安などで、NAcだと報酬という理解でいたため、BLA投射神経のほうがモルヒネに対する感受性が高い、という結果はモルヒネのどういう効果を表しているのであろうか。
オレキシン神経についても逆行性トレーサーを投射先に注入してキャラクタライズし、電気生理学的解析を行うことは可能かもしれないが、何に対する感受性を調べるのがおもしろいのだろうか。グルコース?GABA?Glutamate?
視床下部のスライスパッチクランプは基本的に2週齢までで行われることが多いが、これは視床下部の神経が特に死にやすいためらしい。VTAは比較的丈夫なので6〜8週齢と比較的高齢でも解析に使うことができるようである。
側坐核(Nucleus Accumbens:NAc)や扁桃体外側基底核(Basolateral Amygdala:BLA)などの報酬・依存に関係しているとされている辺縁系の神経核は腹側被蓋野(Ventral Tegmental area:VTA)からドーパミン(Dopamine:DA)による投射を受けている。
VTAのドーパミン神経は薬物依存に強く関係しているとされ、また、NAcやBLAも報酬系においてVTAとは独立した役割を果たしている、とされている。
VTAの神経は一次(primary),二次(secondary),三次(tertiary)という3つのクラスに分けられている。primary neuronはチロシン水酸化酵素(Tyrosine hydroxylase:TH)ポジティブなドーパミン神経であり、secandary neuronはGABAergicである。
また、primaryとtertiaryの神経ではhyperpolarization-activated cation current (Ih)やpace maker firing, long-duration action potentials (APs)といった特徴がある。secondaryの神経はIhがなく、APsの幅も狭い。
オピオイドは鎮痛や鎮咳、下痢止めの薬の成分として用いられ、特にアヘンのケシから精製されるモルヒネ(morphine)は重要なオピエート鎮痛薬である。内在性のオピオイドをコードする遺伝子はβ-エンドルフィンの前駆体であるPOMC、Met-エンケファリンとLeu-エンケファリンの前駆体であるプロエンケファリン、ダイノルフィンの前駆体であるプロダイノルフィンの三種類が存在する。内在性オピオイドのN末端にはTry-Gly-Gly-Pheの共通配列があり、さらにMetかLeuがそれに続く。
オピオイドの受容体はG蛋白共役型受容体(GPCR)としてμ、κ、δの三種類が存在する。それぞれGi/oと共役しているため、
神経におけるリガンドの結合は抑制性に働く。モルヒネ様のオピオイド類やβ-エンドルフィンはμ受容体に優先的に結合する。それに対し、エンケファリンはδ受容体に優先的に結合し、ダイノルフィンはκ受容体に優先的に結合する。
VTAではμオピオイド受容体(μ-opioid receptor:MOR)とκオピオイド受容体(κ-opioid receptor:KOR)が発現している。KORのアゴニストはprimaryとtertiaryの神経を抑制し、MORのアゴニストはsecondaryとtertiaryの神経を抑制する。このsecondary neuronにおけるGABAの放出の抑制が、MORのアゴニストであるモルヒネなどによるドーパミン神経の活性化をもたらし、報酬性・依存性を引き起こす原因になっていると考えられる。
今回紹介する論文では、BLAもしくはNAcに逆行性のトレーサーを注入し、それぞれに投射しているVTAのドーパミン神経がオピオイドの感受性に対して違いを持っているか、ということを検証している。
Ford CP, Mark GP, Williams JT.
Properties and opioid inhibition of mesolimbic dopamine neurons vary according to target location.
J Neurosci. 2006 Mar 8;26(10):2788-97.
6〜8週齢のDBA/2Jマウスを麻酔し、fluorescent microspheres(invitrogen)をNAcもしくはBLAの両側に注入する。2〜5日でmicrosphereは逆行性に移行するため、電気生理学的解析に用いる。
解析したいのはprimaryなドーパミン神経であるため、アクションポテンシャルのスパイクの長さが1.2 msecのものを選択する。
まず、KORのアゴニストとMORのアゴニストについて作用を比較した。KORのアゴニストであるU69593はGIRKを活性化することでVTAのprimaryとtertiaryの神経を抑制することが報告されているが、この論文ではNAcに投射している神経はBLAに投射している神経と比較して非常に大きな外向き電流が流れた。
それに対しμとδのオピオイド受容体アゴニストであるメチオニンエンケファリン(ME)はNAcよりもBLAに投射している神経において大きな外向き電流を流した。
このように同じVTAのドーパミン神経であっても、オピオイドに対する感受性は異なる。特にμ受容体が側坐核(NAc)に投射している神経に少ない、という結果は、モルヒネ依存においてVTA-NAcという系の関与が低い、という事につながるかもしれない。
primaryなドーパミン神経はsecandaryであるGABA神経からの抑制を受けている。次に彼らはこのGABAergic neuronに対するpresynapticな作用を解析した。その結果、μ/δORのアゴニストであるMEはGABAA,GABABのIPSCを抑制した。それに対し、κORのアゴニストであるU69593はBLAに投射しているドーパミン神経のみでGABAA IPSCを抑制し、NAcに投射しているドーパミン神経ではこの抑制作用が見られなかった。逆に、GABAB IPSCはNAc投射神経のほうがBLA投射神経よりも有意に抑制された。
筆者らはここで、BLAに投射しているドーパミン神経ではGABAA受容体が多く発現し、NAcに投射しているドーパミン神経ではGABAB受容体が多く発現しているのかもしれない、と考察しているが、それならばMEなどの反応でも差が出るはずなのではなかろうか。むしろsecondary GABAergic neuronでもκオピオイド受容体の発現に差がある、と見るのが適当だと思うのだが、違うのだろうか?
最後に細胞体や樹状突起からretrogradeに放出されるドーパミンによるD2 IPSCの解析。5回連続で刺激をするとsomato-dendriticなドーパミン放出によるD2 IPSCが観察できるらしい。
その結果、μ/δORアゴニストのMEを作用させてもIPSCの抑制は起こらないが、κORのアゴニストを作用させるとIPSCは抑制されることが分かった。
MEがD2 IPSCにおいて全く作用を及ぼさなかった点について筆者らは、MEの量が足りなかったか、刺激によるDAの放出とμORによるDA IPSC抑制の効果が上手くカップルできなかったせいのどちらかではないか、と考察している。
今回の論文では、同じVTAのドーパミン神経でも投射先によってオピオイドの感受性が異なる、という結果を報告している。
このような投射先によるオピオイド受容体の発現パターンの違いは報酬・依存などにおいて何らかの生理的役割を果たしているのであろうが、BLAだと恐怖・不安などで、NAcだと報酬という理解でいたため、BLA投射神経のほうがモルヒネに対する感受性が高い、という結果はモルヒネのどういう効果を表しているのであろうか。
オレキシン神経についても逆行性トレーサーを投射先に注入してキャラクタライズし、電気生理学的解析を行うことは可能かもしれないが、何に対する感受性を調べるのがおもしろいのだろうか。グルコース?GABA?Glutamate?
視床下部のスライスパッチクランプは基本的に2週齢までで行われることが多いが、これは視床下部の神経が特に死にやすいためらしい。VTAは比較的丈夫なので6〜8週齢と比較的高齢でも解析に使うことができるようである。
|
|
|
|
|
|
|
|
ジャーナルクラブ 更新情報
-
最新のイベント
-
まだ何もありません
-
-
最新のアンケート
-
まだ何もありません
-
ジャーナルクラブのメンバーはこんなコミュニティにも参加しています
人気コミュニティランキング
- 1位
- 暮らしを楽しむ
- 77630人
- 2位
- 酒好き
- 171818人
- 3位
- 音楽が無いと生きていけない
- 196539人